
10 mar Epilepsia Mioclônica Juvenil
Tiempo de lectura: 11 minutosIntrodução
Casos clássicos de Epilepsia Mioclônica Juvenil (EMJ) são reportados desde o século 19, na França e Suíça, mas a primeira descrição clínica detalhada desta síndrome foi publicada por Janz e Christian, em 1957, em sua série histórica de 47 pacientes com impulsive petit mal.1
Atualmente, estima-se que corresponda a 2,8-11,9% de todas as epilepsias e 26,7 das epilepsias generalizadas genéticas.2 O tipo de crise indispensável para o diagnóstico é citado no nome da síndrome — crise mioclônica — e caracteriza-se por abalos musculares súbitos e arrítmicos que ocorrem logo após o despertar. Crises tônico-clônicas generalizadas frequentemente estão associadas e crises de ausência também podem ocorrer.3
Síndrome de provável origem poligênica, inicialmente não associada a alterações morfológicas, com o avanço das técnicas propedêuticas têm sido detectadas alterações sutis em substância cinzenta
e no metabolismo de neurotransmissores à positron emission tomography (PET).4 Na EMJ, o controle satisfatório das crises é alcançado quando o medicamento anticrise (MAC) apropriado é instituído; contudo, é necessário ser criterioso nesta escolha, uma vez que se trata de uma epilepsia
de longa duração e alto risco de recorrência de crises com a suspensão dos MACs. Os pacientes farão uso do medicamento por longos anos, com impacto em várias fases da vida.5
Casos Clínicos
Procurou acompanhamento neurológico com relato de apresentar uma a duas crises tônico-clônicas generalizadas ao ano, que ocorriam quando era submetida à privação de sono. A primeira crise acontecera aos 13 anos. Relatou ainda “espasmos” musculares, envolvendo tronco e membros
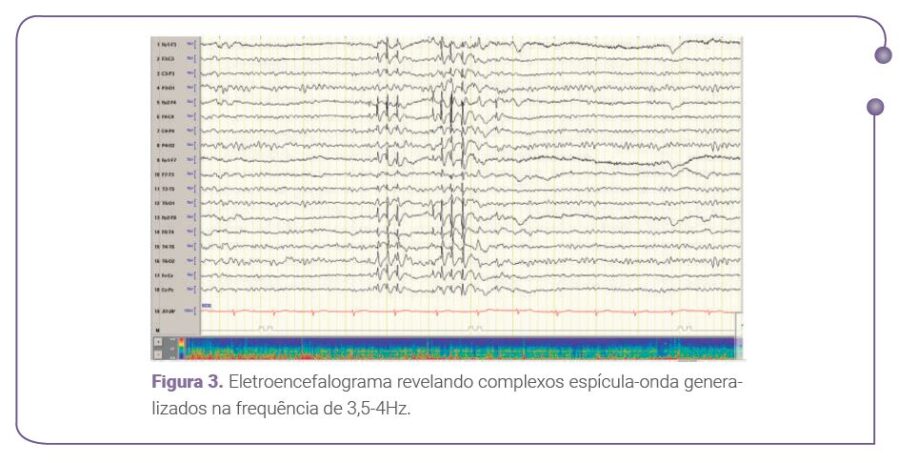
superiores logo após o despertar. Informou nunca ter ficado completamente livre destes abalos, mesmo em uso de 400 mg de lamotrigina (LTG) ao dia. Manifestava o desejo de engravidar até os 38 anos. Sua ressonância magnética (RM) cerebral mostrou- se sem alterações (Figura 1); o eletroencefalograma (EEG) revelou atividade de base normal (Figura 2) e complexos espícula-onda generalizados na frequência de 3,5-4Hz (Figura 3).
Discussão
A Classificação Internacional das Epilepsias e Síndromes Epilépticas da International League Against Epilepsy (ILAE) reporta que a EMJ tem início na puberdade, é caracterizada por crises de abalos musculares súbitos, bilaterais, arrítmicos, irregulares, isolados ou em salvas, que predominam nos membros superiores — crises mioclônicas. A consciência permanece preservada e alguns pacientes
podem apresentar queda súbita ao solo.3 Em 80-95% dos casos, há também crises tônico-clônicas generalizadas, e crises de ausência ocorrem em um terço dos casos.7 As crises têm início dos 8 aos 24 anos, em média aos 14 anos. É marcante a ocorrência destas logo após o despertar, associadas a
fatores desencadeantes, tais como privação de sono, fadiga e uso de álcool.2
A EMJ destaca-se como uma síndrome que apresenta traços reflexos. Um quarto dos pacientes tem fotossensibilidade, em torno de 20%, sensibilidade ao fechamento ocular, e são vistas ainda mioclonias orofaciais reflexas e ativação da atividade epileptogênica por práxis.8 A fotossensibilidade induzindo crises ou descargas ao EEG parece ser um traço genético independente
frequente na EMJ.9 A ativação por práxis é um reflexo complexo envolvendo conexões entre a área motora suplementar, córtex motor e funções cognitivas frontoparietais, que participam de tarefas que exigem tomada de decisão.10 Estes pacientes, geralmente, apresentam pior resposta ao tratamento medicamentoso.11
Classicamente, era descrito que os pacientes com EMJ apresentavam RM cerebral normal;
entretanto, com o advento de métodos de investigação mais sofisticados, tem sido detectado aumento do volume da substância cinzenta no giro frontal médio bilateral e cíngulo anterior.12 RM com espectroscopia revela disfunção talâmica e cortical frontal bilateral que estende até os lobos occipitais nos pacientes com fotossensibilidade.13 A PET-Scan cerebral revela alteração no metabolismo do córtex pré-frontal dorsolateral e em outras regiões corticais.14 Vários estudos
têm mostrado aumento de comorbidades psiquiátricas (26,5-45%) e perfil neuropsicológico
específico entre os pacientes com EMJ, compatível com disfunções em áreas frontais, o que estaria relacionado a prognóstico social de longo prazo em alguns casos.15
Estudo recente em um centro terciário de assistência a pessoas com epilepsia, em São Paulo, revelou que os pacientes com EMJ têm sintomas ansiosos mais severos e maior dificuldade de adaptação social. Estes achados foram associados a crises mais frequentes e à farmacorresistência.16 O isolamento social e a limitação à prática de esportes e lazer são problemas para 30% dos pacientes.
17 Em detrimento da boa resposta ao tratamento, 75% das pessoas com EMJ apresentam ao menos um fator importante que compromete sua inserção social satisfatória, tais como incapacidade de concluir o Ensino Médio, gravidez não planejada, depressão, desemprego ou isolamento social.18
O EEG é peça-chave no diagnóstico. Nos pacientes com EMJ, a atividade de base é caracteristicamente preservada. Os paroxismos epileptiformes interictais são representados por complexos espícula-onda, irregulares, em uma frequência de 3-6 Hz, de predomínio frontal, vistos no início sono e na vigília. Assimetrias e focalidades são identificadas em até 48% dos casos.19 Durante as mioclonias, o traçado revela ritmos rápidos generalizados com frequência em torno de 20Hz. Potenciais evocados somatossensitivos gigantes são descritos em 35-50% dos casos.20
A maioria dos pacientes responde bem ao tratamento medicamentoso e às medidas comportamentais, apresentando habilidades cognitivas preservadas. Apenas 10% deles evoluem com crises de difícil controle.2 Neste contexto é importante estarmos atentos a casos de pseudorrefratariedade, quando o paciente tem estilo de vida inadequado, faz uso incorreto dos medicamentos ou não adere ao tratamento. Essa situação tem sido descrita em 9% dos pacientes com EMJ.21
Mais da metade dos pacientes apresenta recorrência das crises com a retirada dos medicamentos.
Os fatores associados a maior risco de recorrência são controversos, mas têm sido citados, além da presença de ativação por práxis e fotoestímulo, idade precoce da primeira crise, presença dos três tipos de crises, evolução a partir da Síndrome de Ausência Infantil e comorbidades psiquiátricas.
22 Tendo em vista esse alto índice de recorrência e a necessidade do uso de MAC por longos anos, é imperativa a escolha de um medicamento bem tolerado e que promova o controle adequado das crises.
Tratamento
As bases da escolha dos medicamentos para tratamento das epilepsias é tolerabilidade e segurança. Embora não haja estudos randomizados duplo-cego e controlados comparando medicamentos no tratamento da EMJ, resultados do estudo Standard and New Antiepileptic Drugs (SANAD) suportam
a superioridade do uso VPA em relação à LTG e ao topiramato (TPM), para as epilepsias com crises generalizadas.23 Penry et al, em 1986, reportavam e eficácia do VPA no controle de crises na EMJ, com 86% de seus pacientes livres dos eventos epilépticos.24 Essa informação é reforçada por poucos dados de estudos randomizados comparativos25 e observacionais.26 Apesar destes resultados, em 2015 a agência reguladora de medicamentos e produtos de saúde da Europa (Medicines and Healthcare Products Regulatory Agency – MRHA) – emitiu uma declaração de que o VPA não deveria ser prescrito para crianças e adolescentes do sexo feminino e mulheres em idade fértil, a menos que outros tratamentos tenham sido inefetivos ou não tolerados.27 Há longa data é reconhecido o elevado risco de malformações congênitas maiores em exposição ao VPA no primeiro trimestre de gestação,28 além do prejuízo cognitivo no longo prazo para estas crianças.29 Antes da disponibilidade do VPA, Janz e Christian referiam controle adequado das crises com os barbitúricos, fenobarbital (PB) e primidona (PMD).1
O levetiracetam (LEV) é um fármaco de amplo espectro que tem se mostrado eficaz em monoterapia para o tratamento de crises de início focal em pacientes com epilepsia recém-diagnosticada, bem como terapia adjuvante em epilepsias com crises de início focal ou generalizadas. Possui estrutura molecular e mecanismos de ação, embora não ainda completamente compreendidos, diferentes de todos os outros MAC disponíveis.30 Sabe-se que é um derivado da pirrolidona, que age na proteína das vesículas sinápticas 2A (SV2A) modulando a exocitose de neurotransmissores,31 reduzindo a liberação dos estoques de cálcio intracelular,32 estabilizando receptores GABAA disfuncionais33
e inibindo a sincronização excessiva entre os neurônios.34 Esses mecanismos de ação diferenciam o LEV dos MAC tradicionais, que agem preferencialmente em canais de sódio e receptores GABA.3
Rapidamente absorvido via oral, o LEV tem biodisponibilidade estimada em 100%, possui farmacocinética linear e atinge estabilidade sérica máxima em torno de uma hora quando ingerido sem alimentos. A ligação proteica deste fármaco é desprezível, menor que 10%. Não há metabolismo
intenso, tendo como principal via metabólica a hidrólise pelo grupo enzimático acetamida, presente em vários tecidos do corpo, inclusive nas células sanguíneas, e seu principal metabólito é inativo.35 Destacando o LEV dos fármacos tradicionais, não há ação na família do citocromo P450 hepático, não causando indução deste sistema. Desta forma, o levetiracetam é uma opção particularmente interessante para pacientes com comorbidades ou que necessitem do uso de medicamentos por outras condições.35
Entre os MAC modernos, o LEV é o mais promissor para o controle de crises e a tolerabilidade nos pacientes com EMJ. Durante a gestação, o LEV está entre as opções mais seguras, seguido da LTG. Contudo, o nível sérico da LTG durante a gestação é bastante instável, aumentando o risco de
crises. O TPM, além de perda de peso e impacto negativo na cognição, aumenta o risco de malformações, sobretudo fenda palatina.
O risco de malformação maior com uso de LVT reportado pelo International Registry of Antiepileptic Drugs and Pregnancy – EURAP, um banco mundial com registro de gestações que ocorrem em diversos países, é de 1,6%.36 Desta forma, o LEV é a primeira escolha para o tratamento da EMJ de mulheres em idade fértil.37 É importante estarmos atentos à queda dos níveis séricos em torno de 30-40%, durante a gestação, que ocorre provavelmente por aumento da eliminação renal e retornam ao basal prévio no pós–parto.38 Devido à baixa ligação à proteína, o fármaco é extensamente transferido pelo leite materno, mas é bem tolerado, e estudos mostraram baixos níveis séricos no neonato.39 Não há evidências de que as mulheres com EMJ apresentem aumento de crises no
pós-parto, todavia, é um período de maior estresse e privação de sono.40
Crises catameniais são aquelas que apresentam aumento em frequência segundo a fase do ciclo menstrual. Sabemos que o estrogênio tem uma ação pró-convulsivante, enquanto a progesterona modula esta ação. Não há tratamento aprovado pela U.S. Food Drug Administration (U.S. FDA) para abordagem destas crises, mas séries de casos têm demonstrado efeitos positivos do uso do
LEV intermitente neste contexto em pacientes que não respondem aos tratamentos convencionais. Visto que esse medicamento tem mínima interação com os hormônios, esta opção é particularmente interessante.41 Por esta mesma propriedade, é útil também para mulheres que fazem uso de contraceptivos hormonais.42
Discussão dos caso
Na escolha de qual MAC devemos usar para o tratamento dos casos exemplificados, é necessário que façamos algumas ponderações. O caso 1 apresenta uma paciente do sexo feminino com mioclonias matinais e crises tônico-clônicas generalizadas após privação de sono. O EEG com complexos espícula-onda generalizados corrobora nossa hipótese de EMJ. Sendo mulher em idade fértil, é importante a escolha de medicamentos seguros para caso ocorra gestação, o que permitirá uso concomitante com contraceptivos e com potencial de controle adequado de crises mioclônicas e tônico-clônicas generalizadas. Neste caso, o levetiracetam é o MAC de escolha para associação. O VPA e o TPM são desaconselhados pelo risco de teratogenicidade. A LTG é uma boa opção, contudo é necessário cautela caso aconteça uma gestação, em virtude da instabilidade dos níveis séricos, aumentando o risco de crises.
Considerações finais
Em ambas as situações é importante o controle das crises e o bem-estar global do indivíduo. Como reportado previamente, crises frequentes estão associadas à maior incidência de transtornos psiquiátricos, ao prejuízo funcional e à inserção social. O principal objetivo no tratamento das pessoas com epilepsia é não só o controle das crises, mas a integração à sociedade com qualidade de vida. Para tal, é imperativa a escolha de um MAC adequado e levetiracetam faz-se um
pilar no tratamento da EMJ.
Referências
1. Genton P, Gelisse P. The history of juvenile myoclonic epilepsy. Vol. 28, Epilepsy and Behavior. Epilepsy Behav; 2013. 2. Mesraoua
B, Deleu D, Al Hail H, et al. Juvenile Myoclonic Epilepsy: An Update. In: Epilepsy Topics. InTech; 2014. 3. Roger J, Dreifuss FE,
Martinez-Lage M, et al. Proposal for Revised Classification of Epilepsies and Epileptic Syndromes: Commission on Classification
and Terminology of the International League Against Epilepsy. Epilepsia. 1989;30(4):389-99. 4. Wolf P, Yacubian EMT, Avanzini G,
et al. Juvenile myoclonic epilepsy: A system disorder of the brain. Epilepsy Research; 2015;114:2-12. 5. Höfler J, Unterberger I,
Dobesberger J, et al. Seizure outcome in 175 patients with juvenile myoclonic epilepsy – A long-term observational study. Epilepsy
Res. 2014;108(10):1817-24. 6. Zang Y, Chen J, Liu W, et al. Clinical features and treatment outcomes of Juvenile myoclonic epilepsy
patients. 2019. 7. Guaranha MSB, Filho GMDA, Lin K, et al. Prognosis of juvenile myoclonic epilepsy is related to endophenotypes.
Seizure. 2011;20(1):42–8. 8. Verrotti A, Beccaria F, Fiori F, et al. Photosensitivity: Epidemiology, genetics, clinical manifestations,
assessment, and management. Epileptic Disord. 2012;14:349-62. 9. Caciagli L, Wandschneider B, Centeno M, et al. Motor
hyperactivation during cognitive tasks: An endophenotype of juvenile myoclonic epilepsy. Epilepsia. 2020;61(7):1438-52. 10. Uchida
CGP, De Carvalho KC, Guaranha MSB, et al. Phenotyping juvenile myoclonic epilepsy. Praxis induction as a biomarker of unfavorable
prognosis. Seizure. 2015;32:62-8. 11. Cao B, Tang YY, Li JP, et al. A meta-analysis of voxel-based morphometry studies on gray
matter volume alteration in juvenile myoclonic epilepsy. Epilepsy Res. 2013;106(3):370-7. 12. Aydin-Ozemir Z, Terzibasioglu E,
Altindag E, et al. Magnetic resonance spectroscopy findings in photosensitive idiopathic generalized epilepsy. Clin EEG Neurosci.
2010;41(1):42-9. 13. Koepp MJ, Woermann F, Savic I, Wandschneider B. Juvenile myoclonic epilepsy – Neuroimaging findings.
Epilepsy Behav. 2013;28:S40-4.S. 14. Wandschneider B, Thompson PJ, Vollmar C, Koepp MJ. Frontal lobe function and structure in
juvenile myoclonic epilepsy: A comprehensive review of neuropsychological and imaging data. Epilepsia. 2012;53:2091-8. 15. Paiva
ML, Lima EM, Siqueira IB, et al. Seizure control and anxiety: Which factor plays a major role in social adjustment in patients with
Juvenile Myoclonic Epilepsy? Seizure. 2020;80:234–9. 16. Camfield CS, Camfield PR. Juvenile myoclonic epilepsy 25 years after
seizure onset: A population-based study. Neurology. 2009;73(13):1041-5. 17. Baykan B, Martínez-Juárez IE, Altindag EA, et al. Lifetime
prognosis of juvenile myoclonic epilepsy. Epilepsy Behav; 2013;28: S18-24.18. Serafini A, Rubboli G, Gigli GL, et al. Neurophysiology
of juvenile myoclonic epilepsy. Epilepsy Behav; 2013;28: S 30-9. 19. Baykan B, Wolf P. Juvenile myoclonic epilepsy as a spectrum
disorder: A focused review. Seizure. W.B. Saunders Ltd; 2017; pp. 36-41. 20. Gelisse P, Genton P, Thomas P, et al. Clinical factors
of drug resistance in juvenile myoclonic epilepsy. J Neurol Neurosurg Psychiatry. 2001;70(2):240-3. 21. Syvertsen M, Fløgstad I,
Enger U, et al. Antiepileptic drug withdrawal in juvenile myoclonic epilepsy. Acta Neurol Scand. 2019;139(2):192-8. 22. Marson AG,
Al-Kharusi AM, Alwaidh M, et al. The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalised and
unclassifiable epilepsy: an unblinded randomised controlled trial. Lancet. 2007;369(9566):1016-26. 23. Penry JK, Dean JC, Riela
AR. Juvenile Myoclonic Epilepsy: Long‐Term Response to Therapy. Epilepsia. 1989;30:S19-23. 24. Bonnett LJ, Smith CT, Smith D,
et al. Time to 12-month remission and treatment failure for generalised and unclassified epilepsy. J Neurol Neurosurg Psychiatry.
2014;85(6):603-10. 25. Bergey GK. Evidence-based Treatment of Idiopathic Generalized Epilepsies with New Antiepileptic Drugs.
Epilepsia. 2005;46(s9):161-8. 26. Tomson T, Marson A, Boon P, et al. Valproate in the treatment of epilepsy in girls and women of
childbearing potential. Epilepsia. 2015;56(7):1006-19. 27. Campbell E, Kennedy F, Russell A, et al. Malformation risks of antiepileptic
drug monotherapies in pregnancy: Updated results from the UK and Ireland epilepsy and pregnancy registers. J Neurol Neurosurg
Psychiatry. 2014;85(9):1029-34. 28. Bromley R, Weston J, Adab N, et al. Treatment for epilepsy in pregnancy: Neurodevelopmental
outcomes in the child. Cochrane. John Wiley and Sons Ltd; 2014. 29. Kaminski RM, Matagne A, Patsalos PN, Klitgaard H. Benefit of
combination therapy in epilepsy: A review of the preclinical evidence with levetiracetam. Epilepsia. 2009;50(3):387-97. 30. Stahl SM.
Psychopharmacology of anticonvulsants: Levetiracetam as a synaptic vesicle protein modulator. J Clin Psychiatry; 2004;65:1162-3.
31. Cataldi M, Lariccia V, Secondo A, et al. The antiepileptic drug levetiracetam decreases the inositol 1,4,5-trisphosphate-dependent
[Ca2+]i increase induced by ATP and bradykinin in PC12 cells. J Pharmacol Exp Ther. 2005;313(2):720-30. 32. Palma E, Ragozzino
D, Angelantonio S Di, et al. The Antiepileptic Drug Levetiracetam Stabilizes the Human Epileptic GABA A Receptors upon Repetitive
Activation. Epilepsia. 2007;48(10):1842-9. 33. Georg Margineanu D, Klitgaard H. Inhibition of neuronal hypersynchrony in vitro
differentiates levetiracetam from classical antiepileptic drugs. Pharmacol Res. 2000;42(4):281-5. 34. Lyseng-Williamson KA.
Levetiracetam: A review of its use in epilepsy. Drugs. 2011;71(4):489-514. 35. Pennell PB. Too complicated or so simple: AED type
and AED dose matter for pregnancy. Epilepsy Currents. 2012;12:63-5. 36. Brodie MJ. Modern management of juvenile myoclonic
epilepsy. Expert Review of Neurotherapeutics. Taylor and Francis Ltd; 2016;16:681-8. 37. Reisinger TL, Newman M, Loring DW, et al.
Antiepileptic drug clearance and seizure frequency during pregnancy in women with epilepsy. Epilepsy Behav. 2013;29(1):13-8.
38. Tomson T, Palm R, Källén K, et al. Pharmacokinetics of levetiracetam during pregnancy, delivery, in the neonatal period, and
lactation. Epilepsia. 2007;48(6):1111-6. 39. Keni R, Mostacci B, Kiteva-Trenchevska G, et al. Women’s issues*. Epileptic Disord.
2020;22(4):355–63. 40. Liu J, Yu N, Sun H, et al. Intermittent levetiracetam treatment in five patients with catamenial epilepsy. J Pak Med Assoc. 2015;65(7):793-5. 41. Gooneratne IK, Wimalaratna M, Ranaweera AKP, Wimalaratna S. Contraception advice for women with epilepsy. BMJ. 2017;357.
Dra. Ana Paula Gonçalves - CRM-MG 40.593
Neurologista e Neurofisiologista Clínica. Membro Titular da Academia Brasileira de Neurologia. Membro Titular do Departamento Científico da Sociedade Brasileira de Neurofisiologia Clínica Comissão de Cirurgia de Epilepsia e Jovens Líderes da Liga Brasileira de Epilepsia. Preceptora da Residência de Neurologia do Hospital das Clínicas de UFMG e dos Fellows em Epilepsia e
Eletroencefalografia do HC-UFMG e do NATE. Coordenadora da Neurologia Clínica do Hosptial Felício Rocho



Sorry, the comment form is closed at this time.